IBDP化学,涉及知识点范围内容很广泛,包括化学平衡,化学键,及词汇量大的化学有机部分。IB化学课程内容甚至部分涉及到国内高中没有涵盖部分。下面和小编一起详细了解这门学科吧。
01课程目标
DP化学课程考察方式不局限于化学知识点,它更多要求学生深刻理解化学,掌握科学研究的方法,具有独立研究和创新的思考的能力,并能在跨学科领域与他人合作的方式完成项目研究让学生掌握化学的知识,梳理章节脉络,理解IB考点,轻松通过IB考试
02课程大纲
IB Chemistry HL:IB化学HL
Session1:Atomic structure 原子结构
Session2:The periodic table-the transition metals 过渡金属
Session3:Chemical bonding and structure 化学键合与结构
Session4:Energetics/thermochemistry 化学键合与结构
Session5:Chemical kinetics 化学动力学
Session6:Equilibrium 平衡
Session7:Acids and bases 酸和碱
Session8:Redox processes 氧化还原反应
Session9:Organic chemistry 有机化学
Session10:Measurement and analysis 测量及分析
Session11:Mock exam 模拟考试
Session12:Past paper review 历年试卷回顾
IB Chemistry SL:IB化学SL
Session1:Stoichiometric relationship 化学计量关系
Session2:Atomic structure 原子结构
Session3:Atom原子
Session4:Mass spectrometer质谱仪
Session5:electronic structure电子结构
Session6:Periodicity 周期性
Session7:periodic table周期表
Session8:Physical property物理性质
Session9: Chemical property化学性质
Session10:Chemical bonding and structure 化学键合与结构
Session11:Energetics/thermochemistry 能量/热化学
Session12:Chemical kinetics 化学动力学
Session13:Equilibrium 平衡
Session14:Dynamic equilibrium动态平衡
Session15:Equilibrium position平衡位置
Session16:Acids and bases 酸和碱
Session19:pH值
Session20:Redox processes 氧化还原反应
Session21:Organic chemistry 有机化学
Session22:Measurement and data processing 测量及数据处理
Session23:Mock exam 模拟考试
Session24:Past paper review 历年试卷回顾
03考核形式
paper1:IBSL包括30道选择题,HL40道选择题,考察金属和进阶化学章节知识。其中15道两个版本是一样的,不能用计算器,考试过程中学生会收到元素周期表。
paper2:SL和HL统一为短答题。不过,两个版本题库不一样,SL侧重基础化学考察,HL则在基础化学上海包括进阶化学。相比paper1,比较友好的一点是学生可以使用计算器,学校会提供Data booklet。这张试卷,SL和HL的考试难度差别就很明显,难度会大大增加。不过,HL版本中比重下降,因为这部分考察的更多的是记忆以及使用记忆中的知识来解决问题的能力,并不是IBDP最看重的。
paper3:分为两个部分。一部分内容是涉及数据分析和处理的实验题,题量只有一道。另一部分内容是选修课程四个章节中任意选一个,题考察形式也都是短答题。计算器和data booklet。HL这部分的比重加强,原因就是IBDP更看重HL版本学生的实验探究能力。
在对IB化学有了基本的了解后,相必大家对IB化学题跃跃欲试,想亲自上手刷刷题,识别IB化学真题面目。下面小编给大家精心找了IBSL真题,有时间练习起来。
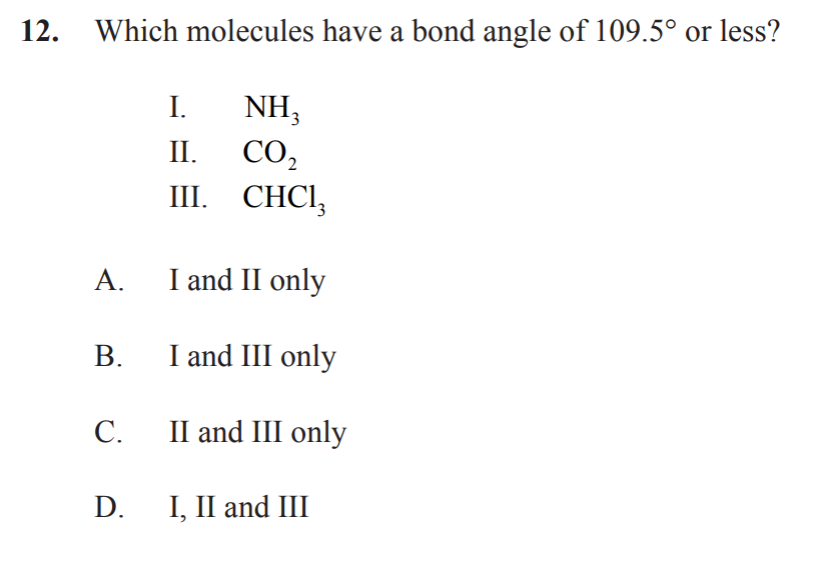
正确答案:B
解析:109.5°和比这个更小的bond angle 是只会出现在tetrahedral,trigonal-pyramidal和bent这三种分子中的,选项里面的CO2是Linear的结构,所有含有II的选项就都不对,所以正确答案是B。
考点:What are the geometries and bond angles of different molecules?
解析:VSEPR里描述molecule时告诉了我们这样几个点:
1. Bond pairs 之间有repulsion,所以它们会尽可能远离彼此。
2. Lone pairs 之间的repulsion 会比bond pairs 之间的更大。
3. Lone pairs 彼此的repulsion最大,其次是lone pairs对bond pairs,最弱的是bond pairs 对彼此的repulsion。
遵循这个理论我们可以看一下,正常的tetrahedral geometry 是由四个bond pairs 组成的,就是下图的methane的样子。
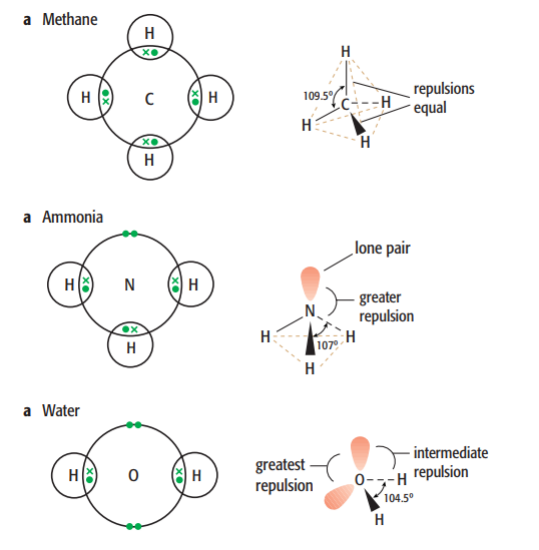
但是我们这里看到ammonia和water,它们分有1-2 lone pairs,这些lone pairs进一步挤压了bond pairs的空间,导致了本来为109.5°的bond angle变得更小了。在有一个lone pair的ammonia中bond angle为107°,两个lone pairs的water里面bond angle进一步减小为104°。
题目中的CO2由于没有lone pair ,只有两个bond pairs所以它如下图所示遵循正常情况是linear geometry。

你的正确率怎么样呢?下面我们为大家准备了一道同类型的题目,请大家一起来试试解答
03
你的演练show







